北京乳牙干细胞储存中心是牙髓干细胞库下设的分支机构,致力于为家庭提供高品质和安全的乳牙干细胞储存服务。储存中心采用自主研发的细胞制备及储存技术,为每个家庭提供一份坚实的生物医疗资源储备保障,以备未来可能的医疗需求。

随着人们生活水平的提高及生活方式的改变, 我国糖尿病患病率飞速增长, 最新的研究数据表明,2013年我国成人糖尿病患病率为10.9%, 糖尿病前期为35.7%, 其中糖尿病的知晓率仅为36.5%, 只有32.2%的患者接受治疗, 且接受治疗的患者中仅有49.2%的患者糖化血红蛋白(glycosylated hemoglobin, HbA1c)得到了有效控制(<7%)[1]. 我国已成为名副其实的全球“糖尿病大国”. 糖尿病慢性并发症严重影响了人们身体健康和生活质量, 由此产生的巨额医疗费用也给国民经济带来了巨大压力, 有效控制和治疗糖尿病已成为一件刻不容缓的战略任务. 胰岛β细胞功能衰竭和胰岛素抵抗是导致糖尿病发生发展的主要机制, 目前的抗糖尿病药物没有针对糖尿病发病的关键环节, 只能解除或缓解症状, 延缓疾病进展, 不能从根本上治愈该疾病. 20世纪初, 有学者设想通过胰腺移植治疗糖尿病[2], 但因供体缺乏和移植后免疫排斥问题制约了其广泛应用, 因此寻找合适的胰岛细胞再生修复方法非常必要. 近年来, 干细胞基础与临床前应用研究的进展为这一问题的解决带来了希望, 我国学者也在糖尿病干细胞治疗的基础和临床研究方面做出了突出贡献.
1 干细胞概述
干细胞是一类较原始的细胞, 他们具有独特的生物学特性, 极强的自我更新能力及多向分化潜能, 在体内发挥重要的组织修复与再生作用. 干细胞根据其分化潜能不同分为全能干细胞、多能干细胞和定向干细胞; 根据个体发育过程中出现的先后次序不同, 又可分为胚胎干细胞和成体干细胞. 胚胎干细胞是从着床前的早期胚胎(囊胚)内细胞团中分离得到的一种二倍体细胞, 理论上具有发育和分化成为机体内几乎所有组织细胞类型的潜能. 成体干细胞是指分布在成体组织中尚未分化的、具有自我更新、并负有构建和补充某种组织的各种类型细胞潜能的干细胞, 理论上成体干细胞在特定条件下可分化为特定的组织器官, 是组织器官修复和再生的基础. 胚胎干细胞定向诱导分化为胰岛素分泌细胞(insulin-producing cells, IPCs)是治疗糖尿病的有效方式, 但目前存在诸多问题: 分化效率低、不稳定; 分化细胞成熟度低, 大多属于胰腺前体细胞, 需要进一步诱导分化成熟; 存在伦理问题和致畸致瘤的风险, 因此目前无法在临床应用. 成体干细胞中的间充质干细胞(mesenchyma stem cells, MSCs)是一类具有强大的自我更新能力和多向分化潜能的成体干细
胞, 可以从成熟的骨髓、脂肪、胎盘、头皮和多种胎儿组织中获得, 它可以分泌一系列生物活性细胞因子和生长因子, 通过调控局部微环境进而促进受损组织修复和再生, 已经被用于治疗多种组织缺损性疾病,也用于促进损伤组织的修复与再生, 其中包括1型及2型糖尿病.
2 干细胞治疗糖尿病的基础研究
2.1 干细胞体外定向分化为IPCs
由于MSCs具有多向分化潜能, 许多科学家致力于将MSCs体外诱导分化为IPCs. 2004年韩国学者将大鼠 (Rattus norvegicus)胰腺提取液加入到大鼠骨髓间充质干细胞(bone marrow stem cells, BM-MSCs)的培养基中可诱导BM-MSCs形成胰岛样结构, 使其表达Pax4, Nkx6.1等基因并分泌胰岛素, 并且20 mmol/L的高糖刺激可使该诱导产物胰岛素分泌增加0.25–0.58 ng/mL, 说明BM-MSCs体外诱导分化的IPCs对高糖具有一定的反应性[3]. 此后, 我国也有学者在这一领域开展了相关研究. 2010年, 台湾学者采用了阶段诱导的方法(首先在培养基中加入神经生长因子β, activin-A, 尼克酰胺以及表皮生长因子, 培养7天; 此后换作无血清培养基, 培养7天; 最后加入尼克酰胺、胰岛素-转铁蛋白-硒以及成纤维细胞生长因子, 再培养17天)将人脐带来源的MSCs体外诱导为IPCs[4]; 将该方法诱导的IPCs植入NOD/SCID小鼠(Mus musculus)肾脏包膜下, 可有效降低小鼠血糖, 且在小鼠血清中检测到人来源C肽.2014年, 我国学者采用类似的阶段培养策略, 但将贴壁培养调整为悬浮培养, 将人来源的BM-MSCs体外诱导产生IPCs, 结果显示诱导产物能够更好地聚集形成团簇样结构, 大大增加了诱导效率[5]. 2016年, 有学者对诱导方法进行了优化调整, 采用三步诱导法(第一阶段, 人来源BM-MSCs在含5% FBS的高糖培养基中培养15天; 第二阶段, 在含有5% FBS和20 μmol/L尼克酰胺低糖培养基中培养7天; 第三阶段, 将10 μmol/Exen din-4加入阶段2培养的培养基中, 再进行7天的孵化)将人来源BM-MSCs体外诱导分化为IPCs, 结果显示43%的诱导产物在高糖刺激下, 可以产生与人胰岛细胞类似的钙离子内流, 提示此种诱导方法生成的IPCs功能更为成熟[6]. 但众所周知, 胚胎干细胞体外诱导为IPCs是通过模拟胚胎干细胞体内发育的过程而完成, 与之相比, 将MSCs诱导为IPCs, 没有体内线索可以依从, 因此目前的诱导方法极为多样化, 可重复性极弱, 诱导效率低, 细胞成分混杂, 细胞成熟度有限, 高糖刺激下并不能很好地分泌胰岛素以及C肽[7], 因此并没有MSCs体外诱导而成的IPCs应用于临床. 综上, 尽管MSCs体外诱导分化为IPCs取得了些许进展, 但仍需要进一步优化诱导方案, 提高诱导效率.
2.2 干细胞改善胰岛β细胞功能
MSCs通过改善胰岛β细胞功能以降低血糖是目前普遍认可的理论假设. 首先, MSCs可促进1型糖尿病和2型糖尿病动物模型胰岛β细胞再生. 无论是1型糖尿病还是2型糖尿病动物模型, 尾静脉输注MSCs后均可使动物随机血糖明显下降, 空腹胰岛素及C肽水平升高, 胰岛β细胞数量较对照组明显增加, 说明MSCs输注能够促进1型及2型糖尿病小鼠或大鼠胰岛β细胞再生[8,9]. MSCs促进胰岛β细胞再生的可能机制包括: (ⅰ) MSCs 归巢至胰腺并分化为IPCs. MSCs具有向损伤组织归巢的能力, 有研究者认为输注的MSCs可归巢至受损胰腺并在体内分化为胰岛β细胞. 但在糖尿病动物模型中,输注入体内的MSCs归巢到胰腺的数量极少, 远不足以解释细胞治疗后诱发的大量新生的β细胞[10], 在这极少量归巢到胰腺的干细胞中, 又仅有一小部分能直接分化为IPCs, 而这部分细胞数量太少, 同样不可能是再生β细胞的主要来源[11]. 因此, MSCs促进胰岛β细胞再生并非依靠干细胞的自身分化. (ⅱ) MSCs促进胰岛β细胞的原位再生. 在多次小剂量STZ诱导的1型糖尿病模型中, 研究者发现MSCs输注后, 新生的胰岛细胞团邻近胰腺导管, 推测导管细胞可能是β细胞原位再生的主要来源[8]. 而本团队未发表数据证明, 在单次大剂量STZ诱导的2型糖尿病大鼠模型中, MSCs通过促进糖尿病大鼠胰岛内α细胞重编程为β细胞而实现胰岛的原位再生, 进而使血糖达到稳步而持久的改善. 2型糖尿病中, 长期的高糖、高脂环境以及慢性炎症状态会导致β细胞去分化为α细胞, 本团队未发表的数据显示, MSCs输注可以通过阻断2型糖尿病大鼠模型中这一过程的发生或促进去分化β细胞再分化为β细胞, 从而增加β细胞的数量. 其次, MSCs可以修复1型糖尿病和2型糖尿病动物模型受损的胰岛β细胞功能. 在1型糖尿病模型NOD小鼠中, MSCs的输注减少了胰岛中Th1型T细胞的浸润, 从而减少了IFN-γ的分泌, 同时增加调
节型T细胞的比例, 从而减少β细胞破坏, 维持β细胞中PDX-1的表达, 改善β细胞功能[12,13]. 体外试验将MSCs 与CD4+ T细胞共培养(细胞与细胞接触), 观察到与CD4+ T细胞单独培养相比, CD4+ CD25+ Foxp3+ 调节型T细胞比例增加, 复制率显著提升. 而在transwell系统中进行细胞共培养, 这种效应被部分削弱, 表明细胞间的接触介导了这一过程. 同时, MSCs可以表达高水平 程序性细胞死亡蛋白配体-1 (programmed death-ligand 1, PD-L1), 其在调节型T细胞的发育和功能维持中起到重要作用. 抑制PD-L1的作用妨碍了与MSCs共培养的CD4+ CD25+ Foxp3+ 调节型T细胞的增殖, 证实MSCs分泌PDL-1在MSCs诱导调节型T细胞扩增/维持中的作用. 在2型糖尿病的发展过程中, 长期的高糖、高脂环境直接或间接通过慢性炎症损伤胰岛β细胞功能. 体外试验表明, MSCs可以促进高糖培养条件下INS-1细胞自噬体和自噬溶酶体的结合, 加速受损线粒体的清除, 调节线粒体功能, 减少INS-1细胞凋亡, 改善INS-1细胞胰岛素的分泌[14]. 经氯喹抑制自噬体和自噬溶酶体的结合, MSCs抑制β细胞凋亡, 改善β细胞功能的效应被大大抑制. 体内试验同样证实MSCs输注可提高2型糖尿病大鼠β细胞中自噬体和自噬溶酶体的融合使β细胞功能改善. 此外, MSCs促进2型糖尿病大鼠胰岛中的巨噬细胞从促炎表型(M1)向抗炎表型(M2)极化, 减少促炎因子、增加抗炎因子的释放, 来修复受损的胰岛β细胞功能. 综上, MSCs可通过促进胰岛β细胞再生和修复受损胰岛β细胞两方面来改善胰岛β细胞功能.
2.3 干细胞改善胰岛素抵抗
胰岛素抵抗也是糖尿病发病的重要机制之一, 此机制在干细胞治疗糖尿病领域长期被忽视, 解放军总医院内分泌科联合基础研究所在干细胞改善胰岛素抵抗方面做了系列工作. 本研究组于2012年在Diabetes上撰文首次提出并证实了干细胞改善胰岛素抵抗的假设[15]: STZ诱导的2型糖尿病大鼠模型分别在第7和21天输注BM-MSCs, 输注后第7天大鼠血糖较输注前显著下降, 但14天后血糖再次升高, 第21天再次输注后大鼠血糖持续下降, 且下降幅度大于第一次输注, 通过大鼠静脉葡萄糖耐量试验及葡萄糖钳夹试验证实,在输注早期BM-MSCs可以通过改善胰岛β细胞功能和改善外周靶组织胰岛素抵抗两种机制缓解大鼠高血糖状态, 而输注晚期则主要通过改善外周组织胰岛素抵抗来达到长期血糖控制的目的. 通过对大鼠胰岛素靶组织胰岛素信号通路相关蛋白的检测证实BM-MSCs通过活化骨骼肌、脂肪和肝脏胰岛素受体底物- 1
(IRS-1)-AKT-GLUT4信号通路改善外周组织胰岛素抵抗而达到降低血糖的目的. 后续的机制研究表明, 脐带华通胶间充质干细胞(umbilical cord-derived mesenchymal stem cells, UC-MSCs)通过分泌IL-6, 上调巨噬细胞IL-4受体的表达, 提高下游STAT6磷酸化水平, 从而促进促炎表型巨噬细胞(M1型)向抗炎表型巨噬细胞(M2)极化. 经MSCs共培养的巨噬细胞激活脂肪细胞中PI3K-AKT表达, 改善其胰岛素抵抗[16]. 体内试验证实UC-MSCs输注增加了脂肪组织中M2型巨噬细胞的比例, 而通过小干扰RNA抑制MSCs中IL-6表达, 显著抑制脂肪组织中M2型巨噬细胞极化, 从而很大程度上抑制MSCs减轻脂肪组织胰岛素抵抗的效应. 脂肪来源间充质干细胞(adipose stromal cells, ASCs)通过激活AMPK磷酸化促进肝脏肝糖原合成并抑制肝糖输出而改善肝脏胰岛素抵抗[17]; 此外UC-MSCs还可通过下调2型糖尿病大鼠肝脏和脂肪组织中慢性炎症小体NLRP3的表达, 改善肝脏和脂肪组织的慢性炎症, 激活PI3K-AKT的表达, 改善大鼠的胰岛素抵抗[18].上述研究结果为干细胞治疗糖尿病奠定了新的理论基础。
3 干细胞治疗糖尿病的临床研究
3.1 干细胞治疗1型糖尿病的临床研究
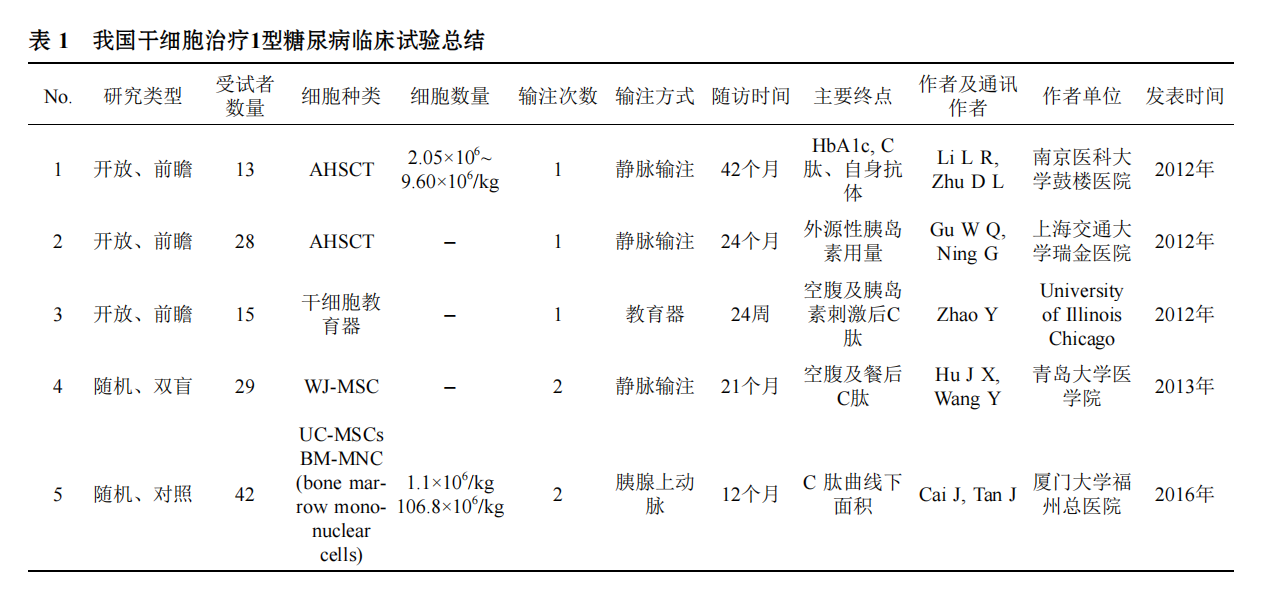
自2010年Voltarelli等人[19]在JAMA上首次发表静脉输注定向造血干细胞治疗15例不伴有糖尿病酮症酸中毒的新诊断1型糖尿病患者(病程小于6周)的有效性及安全性研究后, 我国学者也针对干细胞治疗1型糖尿病开展了系列研究. 2012年南京医科大学附属鼓楼医院的实验结果显示, 13例初诊(病程小于1年, 10例有糖尿病酮症酸中毒)的1型糖尿病患者, 经自体非骨髓根
除的定向造血干细胞(autologous nonmyeloablative hematopoietic stem cell transplantation, AHSCT)治疗后, 11例患者外源性胰岛素用量明显减少且血糖控制达标, 其中3例患者停用外源性胰岛素, 停用时间分别为7个月(后来复用胰岛素为半量)、3年和4年, 笔者认为该效应为AHSCT通过调节免疫活性细胞改善胰岛β细胞功能而实现. 所有受试者在干细胞活化及免疫抑制时出现轻度药物相关细胞毒性相关的恶心、呕吐、发烧、脱发等, 后自行缓解, 仅有1例患者AHSCT治疗后
6月出现伴有高滴度抗甲状腺球蛋白抗体和抗过氧化物酶抗体的亚临床甲减[20]. 同年, 瑞金医院的研究结果也显示静脉输注AHSCT治疗使53.6%的1型糖尿病患者完全停用外源性胰岛素平均达19.3个月(随访时间为4~24个月), 且起病时不伴酮症酸中毒的患者临床缓解率高于起病时伴有酮症酸中毒的患者(70.6% vs. 27.3%). 非糖尿病酮症酸中毒组患者在静脉输注 AHSCT后1月空腹C肽、口服糖耐量试验后C肽峰值以及C肽曲线下面积均明显增加, 且在24个月的随访中持续处于升高状态; 而伴有糖尿病酮症酸中毒组患者的空腹C肽及口服糖耐量试验后C肽峰值仅分别在输注后18和6个月能观察到. 同样多数患者在使用药物行干细胞活化及免疫抑制后出现发热、中性粒细胞减少、恶心、呕吐、脱发及骨髓抑制等症状, 没有严重的急性药物毒性、感染及器官损伤发生, 上述症状在AHSCT输注后2~4周逐渐消失, 整个试验过程中无患者死亡, 且有一例患者在治疗后1年妊娠生下一健康女婴[21]. 2012年有研究者利用干细胞教育(表达胚胎细胞标记物的多能脐带血干细胞)的方式治疗15例平均病程为8年的1型糖尿病患者, 受试者分为残存胰岛β细胞组(A组), 胰岛β细胞耗竭组(B组)和对照组(C组), 结果显示A组干细胞教育治疗后胰岛素用量减少了38%,B组减少了25%, C组无变化, 胰岛素用量减少持续的时间为24周(随访的最长时间). 胰岛β细胞功能评估显示, A组受试者空腹C肽治疗12和24周后明显升高(高 于正常空腹C肽的下限), 75 g OGTT 2 h C肽在治疗后4和12周较治疗前明显升高; B组受试者空腹C肽治疗后12~24周呈持续升高状态, 75 g OGTT 2 h C肽在治 疗后12~40周呈持续升高状态(但均仍低于正常空腹C肽的下限); C组受试者治疗前后胰岛β细胞功能无明显变化. 整个试验过程中除静脉穿刺部位有不适外, 未发现其他不良反应. 机制分析显示干细胞教育通过增加共刺激分子(主要是CD28和ICOS)表达、增加CD4+ CD25+ Foxp3+ Tregs数量、恢复Th1/Th2/Th3细胞因子平衡调节免疫系统从而促进胰岛β细胞再生[22]. 2013年, 青岛大学医学院附属医院发表了为期24个月的UC-MSCs治疗初发1型糖尿病的随机、双盲、安慰剂对照临床研究, 结果显示, 试验组的15例受试者中3例停用胰岛素, 8例胰岛素减量50%以上, 1例患者胰岛素用量减少15%~50%, 另外2例患者胰岛素用量无变化; 对照组14例患者中7例胰岛素用量增加50%, 另外7例增加15%~45%. 治疗组治疗后空腹血糖和餐后血糖的波动明显减少, 而对照组空腹及餐后血糖均波动较大.治疗组空腹C肽及C肽/血糖在治疗1年后明显升高, 后逐渐下降, 但随访2年时仍高于基线; 对照组空腹C肽及C肽/血糖随时间延长逐渐降低. 治疗组在2年的时间内没有糖尿病酮症酸中毒发生, 而对照组中有3例患者发生糖尿病酮症酸中毒. 治疗组中GADA阳性的11例患者中有6例转阴, 而对照组中GADA阳性的10例患者中有3例转阴, 但两者无统计学差异. 整个试验过程中无不良反应发生[23]. 2016年, 厦门大学福州总医院开展了脐带间充质基质细胞联合自体骨髓细胞经胰上动脉移植治疗1型糖尿病患者的随机、对照开放性临床研究, 结果显示: 治疗1年后, OGTT试验C肽曲线下面积 (AUCC-Pep)试验组上升了105.7%, 对照组下降了7.7%; 胰岛素曲线下面积试验组上升了49.3%, 对照组下降了5.7%; HbA1c试验组下降了12.%, 对照组上升了1.2%; 空腹血糖试验组下降了24.4%, 对照组仅下降了4.3%; 日胰岛素需要量试验组下降了29.2%, 对照组无变化. 整个试验过程受试者耐受良好, 无不良反应发生[24]. 虽然国内干细胞治疗1型糖尿病取得了很大进步, 但仍有患者治疗无效或效果差, 解放军总医院研究者分析了AHSCT治疗1型糖尿病远期缓解的预测因素, 结果显示受试者的远期缓解率与基础空腹C肽呈正相关, 而与发病年龄及肿瘤坏死因子α (tumor necrosis factor-α, TNFα)呈负相关[25]. 1型糖尿病发病年龄早, 长期依赖胰岛素治疗, 并发症出现早, 患者生活质量差, 干细胞治疗为1型糖尿病患者带来了希望, 但如何增加疗效, 延长效应时间仍是我国医务工作者需要继续探讨的问题. 我国学者针对干细胞治疗2型糖尿病的临床研究总结见表1.
3.2 干细胞治疗2型糖尿病的临床研究
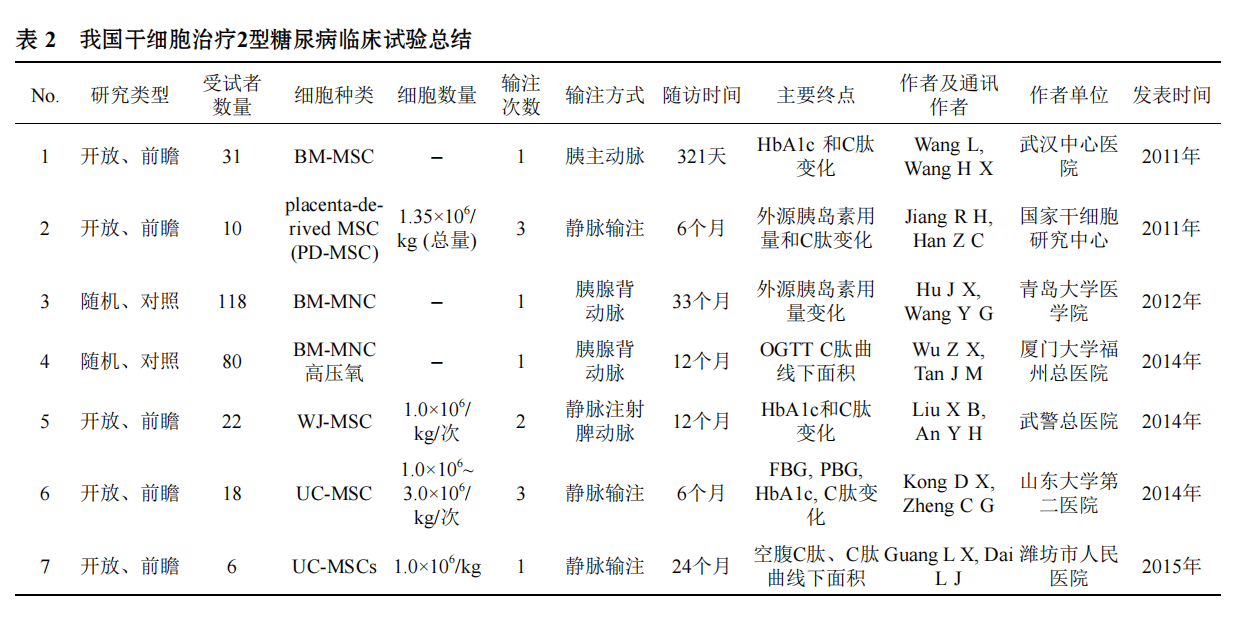
2型糖尿病患病率明显高于1型糖尿病, 且较1型糖尿病有更好的胰岛β细胞基础, 对干细胞治疗的反应更好, 因此2型糖尿病患者更能从干细胞治疗中获益, 我国的科研工作者也针对干细胞治疗2型糖尿病开展了系列研究. 2011年, 武汉中心医院发表了自体BMMSCs治疗2型糖尿病的研究结果: 干细胞治疗30天后HbA1c较治疗前下降1.5%, 但其后又有所回升; 空腹C肽仅在治疗90天后较基线有所上升, 但其他时间均与基线无明显差异, 此结果看似疗效并不理想, 可能与
试验初期细胞处理及患者选择没有优化有关[26]. 同年,国家干细胞工程研究中心研究组使用胎盘来源的间充质干细胞每月静脉输注1次, 连续3次治疗10例2型糖尿病患者的日胰岛素总量从63.7 U减少为34.7 U (4例患者胰岛素用量减少50%), 且空腹C肽水平从4.1 ng/mL 上升至5.6 ng/mL, 试验过程中无不良事件发生[27].2012年, 青岛大学医学院研究组将118例2型糖尿病患
者随机分为2组, 一组接受自体BM-MNCs经导管胰腺注射, 另一组接受胰岛素强化治疗, 随访33个月, BMMNCs治疗组18/56受试者停用胰岛素, 19/56受试者胰岛素用量减少50%, 9/56受试者胰岛素用量不变或减少小于15%; 对照组40/62受试者胰岛素用量增加50%.实验组的HbA1c及C肽水平较治疗前好转, 且明显优于胰岛素强化组, 试验过程中同样未发生近期及远期不良事件[28]. 2014年, 福州总医院同样使用自体BMMNCs联合高压氧治疗2型糖尿病取得良好疗效[29].
2014年, 武警总医院研究组使用脐带华通胶间充质干细胞(Wharton’s Jelly-derived mesenchymal stem cell, WJ-MSC)静脉注射联合经导管胰腺注射治疗22例2型糖尿病患者, 结果显示治疗后患者HbA1c从基线的8.2%下降至3月后的6.89%, 随访至12月时HbA1c仍稳定在7.0%; 空腹C肽治疗后较治疗前升高, 且空腹C肽水平与CD3+ T淋巴细胞的数量下降有关, 但OGTT 2 h
C肽治疗前后无明显差异[30]. 山东大学第二医院研究组同样应用UC-MSCs每2周静脉输注一次, 连续3次治疗18例2型糖尿病患者, 其中8例有效, 10例无效, 有效组的空腹C肽水平和调节T细胞(Treg)明显升高[31]. 2015年, 潍坊市人民医院研究组同样应用UC-MSCs治疗2型糖尿病患者取得良好疗效[32]. 北京军区总医院研究组发表的meta分析显示, BM-MSCs与外周血单核细胞(peripheral bloodmononuclear cells, PB-MSCs)治疗2型糖尿病均可有效控制血糖, 减少胰岛素用量, 并改善胰岛β细胞功能, 干细胞治疗是2型糖尿病有效安全、有前景的治疗方法[33]. 我国学者针对干细胞治疗2型糖尿病的临床研究总结见表2.
4 展望
我国干细胞治疗糖尿病基础和临床研究的开展为医生提供了治疗糖尿病的新武器, 也为糖尿病患者点燃了新的希望. 深入了解干细胞促进胰岛β细胞再生及减轻外周靶组织胰岛素抵抗的分子调控机制, 将会加快糖尿病细胞治疗的研究进展. 虽然目前的临床研究取得了初步的成果, 但目前仍有很多问题尚待解决.通过对目前开展临床试验的总结, 可以看到干细胞的来源、输注途径、输注次数、间隔时间并不统一, 未能形成规范的治疗方案; 哪些患者最能从干细胞治疗中获益, 即干细胞治疗有效性的预测指标尚不明确; 干细胞治疗的远期疗效以及增强并延长干细胞治疗效能的措施尚待研究. 且目前国内外关于干细胞治疗糖尿病的临床试验多为小样本、开放性研究, 治疗1型糖尿病例数最多为42例, 治疗2型糖尿病也仅为118例,且随访时间较短, 不能提供充分的临床证据, 就循证医学证据等级来说, 大样本随机双盲对照RCT试验处于金字塔尖, 因此, 尽快完成干细胞治疗糖尿病的大样本RCT试验至关重要.总之, 目前干细胞治疗糖尿病还需大样本、随机、对照、双盲试验进一步证实其有效性及安全性,建立规范化输注方案, 统一提取方法及鉴定标准, 深入探索机制, 进一步增强MSCs的疗效, 从而尽早使其真正走向临床
参考文献:
1 Wang L, Gao P, Zhang M, et al. Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013. JAMA, 2017, 317: 2515
2 Battezzati A, Bonfatti D, Benedini S, et al. Spontaneous hypoglycaemia after pancreas transplantation in Type 1 diabetes mellitus. Diabet Med, 1998, 15: 991–996
3 Choi K S, Shin J S, Lee J J, et al. In vitro trans-differentiation of rat mesenchymal cells into insulin-producing cells by rat pancreatic extract. Biochem Biophys Res Commun, 2005, 330: 1299–1305
4 Wang H S, Shyu J F, Shen W S, et al. Transplantation of insulin-producing cells derived from umbilical cord stromal mesenchymal stem cells to treat NOD mice. Cell Transplant, 2011, 20: 455–466
5 Zhang Y, Dou Z. Under a nonadherent state, bone marrow mesenchymal stem cells can be efficiently induced into functional islet-like cell clusters to normalize hyperglycemia in mice: a control study. Stem Cell Res Ther, 2014, 5: 66
6 Xin Y, Jiang X, Wang Y, et al. Insulin-producing cells differentiated from human bone marrow mesenchymal stem cells in vitro ameliorate streptozotocin-induced diabetic hyperglycemia. PLoS ONE, 2016, 11: e0145838
7 Bhonde R R, Sheshadri P, Sharma S, et al. Making surrogate β-cells from mesenchymal stromal cells: perspectives and future endeavors. Int J Biochem Cell Biol, 2014, 46: 90–102
8 Lee R H, Seo M J, Reger R L, et al. Multipotent stromal cells from human marrow home to and promote repair of pancreatic islets and renal glomeruli in diabetic NOD/scid mice. Proc Natl Acad Sci USA, 2006, 103: 17438–17443
9 Hao H, Liu J, Shen J, et al. Multiple intravenous infusions of bone marrow mesenchymal stem cells reverse hyperglycemia in experimental type 2 diabetes rats. Biochem Biophys Res Commun, 2013, 436: 418–423
10 Hess D, Li L, Martin M, et al. Bone marrow-derived stem cells initiate pancreatic regeneration. Nat Biotechnol, 2003, 21: 763–770
11 Lechner A, Yang Y G, Blacken R A, et al. No evidence for significant transdifferentiation of bone marrow into pancreatic beta-cells in vivo. Diabetes, 2004, 53: 616–623
12 Madec A M, Mallone R, Afonso G, et al. Mesenchymal stem cells protect NOD mice from diabetes by inducing regulatory T cells. Diabetologia, 2009, 52: 1391–1399
13 Bassi Ê J, Moraes-Vieira P M M, Moreira-Sá C S R, et al. Immune regulatory properties of allogeneic adipose-derived mesenchymal stem cells in the treatment of experimental autoimmune diabetes. Diabetes, 2012, 61: 2534–2545
14 Zhao K, Hao H, Liu J, et al. Bone marrow-derived mesenchymal stem cells ameliorate chronic high glucose-induced β-cell injury through modulation of autophagy. Cell Death Dis, 2015, 6: e1885
15 Si Y, Zhao Y, Hao H, et al. Infusion of mesenchymal stem cells ameliorates hyperglycemia in type 2 diabetic rats: identification of a novel role in improving insulin sensitivity. Diabetes, 2012, 61: 1616–1625
16 Xie Z, Hao H, Tong C, et al. Human umbilical cord-derived mesenchymal stem cells elicit macrophages into an anti-inflammatory phenotype to alleviate insulin resistance in type 2 diabetic rats. Stem Cells, 2016, 34: 627–639
17 Xie M, Hao H J, Cheng Y, et al. Adipose-derived mesenchymal stem cells ameliorate hyperglycemia through regulating hepatic glucose metabolism in type 2 diabetic rats. Biochem Biophys Res Commun, 2017, 483: 435–441
18 Sun X, Hao H, Han Q, et al. Human umbilical cord-derived mesenchymal stem cells ameliorate insulin resistance by suppressing NLRP3 inflammasome-mediated inflammation in type 2 diabetes rats. Stem Cell Res Ther, 2017, 8: 241
19 Voltarelli J C, Couri C E B, Stracieri A B P L, et al. Autologous nonmyeloablative hemaopoietic stem cell transplantation in newly diagnosed typ 1 diabetes mellitus. JAMA, 2010, 23: 1568–1576
20 Li L, Shen S, Ouyang J, et al. Autologous hematopoietic stem cell transplantation modulates immunocompetent cells and improves β-cell function in chinese patients with new onset of type 1 diabetes. J Clin Endocrinol Metab, 2012, 97: 1729–1736
21 Gu W, Hu J, Wang W, et al. Diabetic ketoacidosis at diagnosis influences complete remission after treatment with hematopoietic stem cell transplantation in adolescents with type 1 diabetes. Diabetes Care, 2012, 35: 1413–1419
22 Zhao Y, Jiang Z, Zhao T, et al. Reversal of type 1 diabetes via islet β cell regeneration following immune modulation by cord blood-derived multipotent stem cells. BMC Med, 2012, 10: 3
23 Hu J, Yu X, Wang Z, et al. Long term effects of the implantation of Wharton’s jelly-derived mesenchymal stem cells from the umbilical cord for newly-onset type 1 diabetes mellitus. Endocr J, 2013, 60: 347–357
24 Cai J, Wu Z, Xu X, et al. Umbilical cord mesenchymal stromal cell with autologous bone marrow cell transplantation in established type 1 diabetes: a pilot randomized controlled open-label clinical study to assess safety and impact on insulin secretion. Dia Care, 2016, 39: 149–157
25 Xiang H, Chen H, Li F, et al. Predictive factors for prolonged remission after autologous hematopoietic stem cell transplantation in young patients with type 1 diabetes mellitus. Cytotherapy, 2015, 17: 1638–1645
26 Wang L, Zhao S, Mao H, et al. Autologous bone marrow stem cell transplantation for the treatment of type 2 diabetes mellitus. Chin Med J (Engl), 2011, 124: 3622-3628
27 Jiang R, Han Z, Zhuo G, et al. Transplantation of placenta-derived mesenchymal stem cells in type 2 diabetes: a pilot study. Front Med, 2011, 5: 94–100
28 Hu J, Li C, Wang L, et al. Long term effects of the implantation of autologous bone marrow mononuclear cells for type 2diabetes mellitus.Endocr J, 2012, 59: 1031–1039
29 Wu Z, Cai J, Chen J, et al. Autologous bone marrow mononuclear cell infusion and hyperbaric oxygen therapy in type 2 diabetes mellitus: an open-label, randomized controlled clinical trial. Cytotherapy, 2014, 16: 258–265
30 Liu X B, Zheng P, Wang X D, et al. A preliminary evaluation of efficacy and safety of Wharton’s jelly mesenchymal stem cell transplantation in patients with type 2 diabetes mellitus. Stem Cell Res Ther, 2014, 23: 57
31 Kong C D, Zhuang C X, Wang C D, et al. Umbilical cord mesenchymal stem cell transfusion ameliorated hyperglycemia in patients with type 2 diabetes mellitus. Clin Lab, 2014, 60: 1969–1976
32 Guan L X, Guan H, Li H B, et al. Therapeutic efficacy of umbilical cord-derived mesenchymal stem cells in patients with type 2 diabetes. Exp Therapeut Med, 2015, 9: 1623–1630
33 Wang Z X, Cao J X, Li D, et al. Clinical efficacy of autologous stem cell transplantation for the treatment of patients with type 2 diabetes mellitus: a meta-analysis. Cytotherapy, 2015, 17: 956–968
收稿日期: 2018-03-16; 接受日期: 2018-06-03; 网络版发表日期: 2018-07-10
国家自然科学基金(批准号: 81700679, 81700680)资助