北京乳牙干细胞储存中心是牙髓干细胞库下设的分支机构,致力于为家庭提供高品质和安全的乳牙干细胞储存服务。储存中心采用自主研发的细胞制备及储存技术,为每个家庭提供一份坚实的生物医疗资源储备保障,以备未来可能的医疗需求。
膝骨性关节炎(knee osteoarthritis,KOA)是由多种因素引起的关节软骨退行性疾病,多见于中老年或膝关节损伤,与衰老和关节损伤有关。关节软骨因其缺乏神经和关节微血管滋养,在发生退行性改变后很难自愈或修复。影像学典型的三大特征是受累关节非对称关节间隙变窄,软骨骨硬化或囊性变及关节边缘骨赘形成 [1]。常见症状为膝关节渐进性疼痛,关节肿胀或强直,活动受限,并不断加重。膝骨性关节炎的治疗主要是保守治疗和手术。保守治疗包括药物、针灸、理疗和适当的关节运动等,可缓解症状,但很难阻止或控制软骨退行性病变的发展 [2-3],以致于病情进行性加重,而不得不采取手术治疗。手术治疗包括微骨折技术、软骨移植技术(如基质支持的自体软骨细胞移植等)、截骨术、单间室膝关节置换术和全膝关节置换术等。微骨折技术可引起纤维软骨形成和软骨下骨的力学结构改变,不利于软骨生长。自体软骨移植术需接受 2 次侵入性手术,且需植入 3D 支架,存在移植物抗宿主反应的风险 [2]。虽然关节置换术可快速恢复膝关节功能,但存在继发感染、神经血管损伤和骨质溶解等风险。因此,寻找有效地改善软骨损伤、缓解症状和维持膝关节功能的治疗方法是患者和临床医生的迫切需要。近年来,关节腔注射间充质干细胞(mesenchymal stem cells,MSCs)的治疗受到广泛关注,成为延缓或控制膝关节炎的希望。MSCs具有中胚层分化潜质和旁分泌能力,可通过抑制炎症性 T 细胞增殖,单核细胞成熟和抗炎细胞因子表达调节免疫平衡,滋养和修复软骨组织,无严重副作用。本文通过 Pubmed、国内万方数据库和 clinicaltrials.gov,收集了 2017 ~ 2020 年MSCs 治疗 KOA 的临床试验文献,就临床研究结果、治疗效果、存在的问题和发展前景进行综述。
一、MSCs 的临床研究回顾
1966 年,前 苏 联 科 学 家 Alexander J. Friedenstein 在 豚鼠骨髓培养时最早发现具有分化能力的细胞 [4],但是直到1991 年,这类细胞才被美国科学家 Arnold Caplan 正式命名为MSCs,后者后来也被誉为“间充质干细胞之父”[5]。MSCs 来自中胚层,具有多向分化能力,也可从骨髓、脐带、胎盘、肌腱、牙髓和脂肪等组织中分离培养出来 [6]。关节损伤(如软骨局部缺血或损伤)可引起微环境中趋化因子释放,促发 MSCs 局部归巢,而 MSCs 分泌的生长因子、细胞因子、趋化因子及细胞外基质也可促进局部损伤的修复与重建。进一步研究证实MSCs 的旁分泌作用可激活细胞信号通路,在滋养软骨和修复损伤中起重要作用 [7]。多年来的实验研究也揭示了 MSCs 参与调节机体免疫作用的机制,例如,抑制树突细胞成熟、体内T 淋巴细胞的活化和抗体分泌;抑制 B 淋巴细胞活化、增殖及抗体分泌;改变巨噬细胞的极化及促炎型细胞的分化等 [8]。因此,静脉回输 MSCs 也用于抑制移植后免疫排斥反应 [9]。
二、MSCs 治疗 KOA 的临床研究进展
KOA 治疗所用 MSCs 大多数来自自体,少量来自异体。除了外源性 MSCs 外,成人膝关节也存在不同类型干细胞 /祖细胞。当软骨损伤时,就会被动员、迁移到损伤部位,参与再生修复 [10],但是这种功能往往在中老年阶段减退,不能满足软骨修复的需要。首次开展用 MSCs 治疗兔软骨损伤的实验是在 1994 年 [11],而开展关节腔注射 MSCs 治疗关节损伤是 2003 年用山羊模型完成的 [12],人关节腔内注射 MSCs始 于 2007 和 2008 年。 从 2008 年 到 2020 年,MSCs 治 疗KOA 的注册临床试验数量呈上升趋势(图 1)。
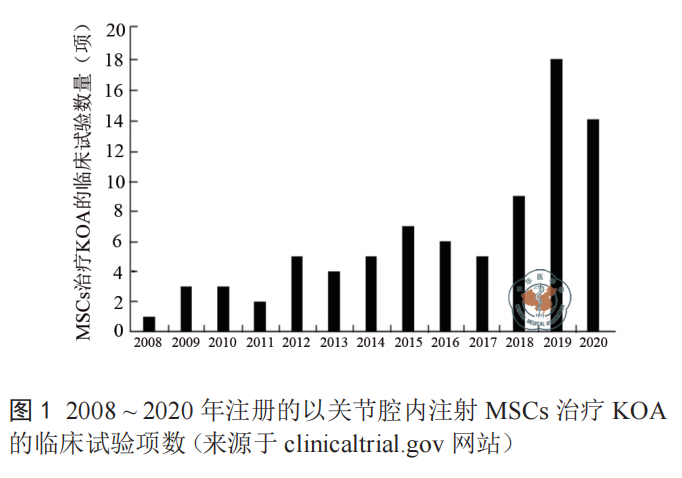
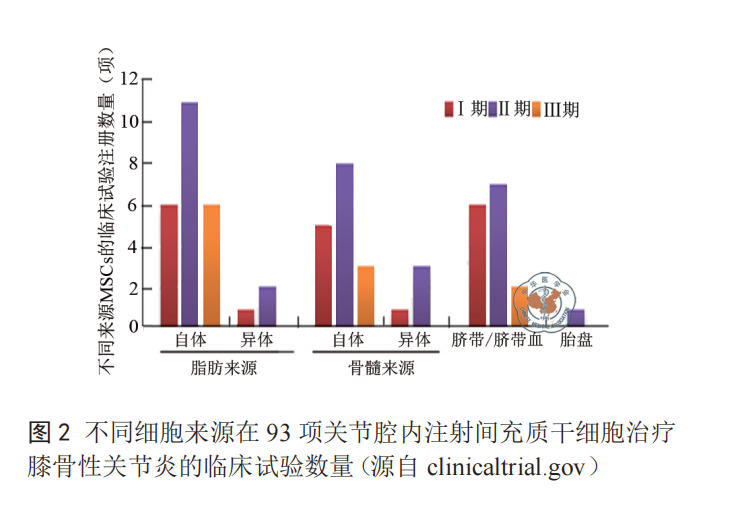
截止 2020 年12 月,在 clinicaltrials.gov 上登记的 MSCs 治疗 KOA 的临床试验共 93 项,以 2019 年登记的项目最多,总数达 18 项。大部分临床试验的给药方式为关节腔内注射 MSCs 或 MSCs 与其他生物成分的混合制剂。从 MSCs 来源分析,大多数临床试验用的 MSCs 源于自体脂肪、自体骨髓或脐带,少量来自异体脂肪或异体骨髓,以脂肪来源的最多,其次是骨髓和脐带血(图 2)。
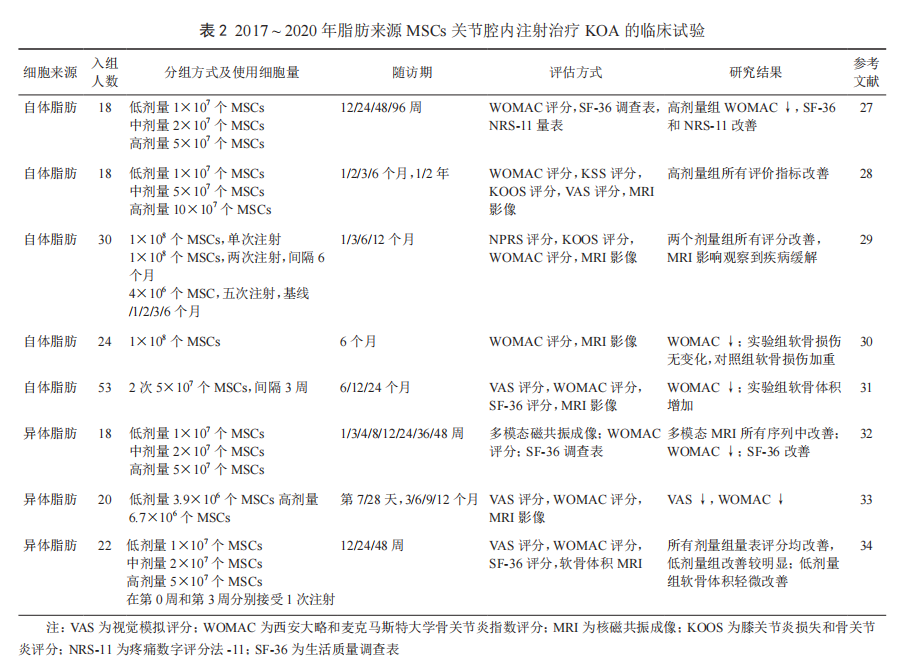
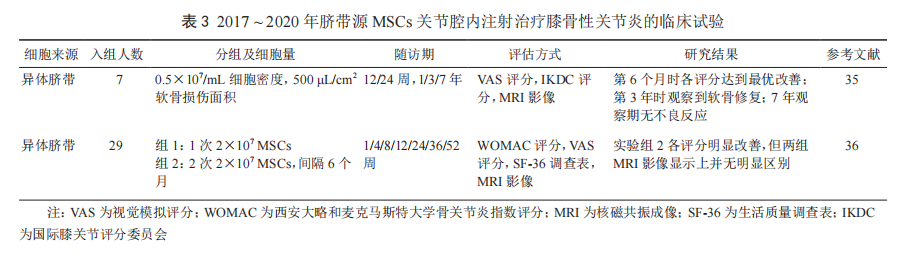
无论关节腔内注射自体还是异体 MSCs,临床上 KOA 治疗中均获得不同程度的改善,且未见致瘤和感染等不良反应发生。为了更好地了解近期 MSCs 治疗 KOA 的疗效,以 MSCs 和 KOA 为关键词,从 Pubmed 上收集在 2017 ~ 2020 年期间开展临床试验的有关文献,分别归纳了从骨髓、脂肪和脐带 3 种来源的MSCs 治疗 KOA 的临床试验进展(表 1 ~ 3)。
(一)骨髓来源的 MSCs
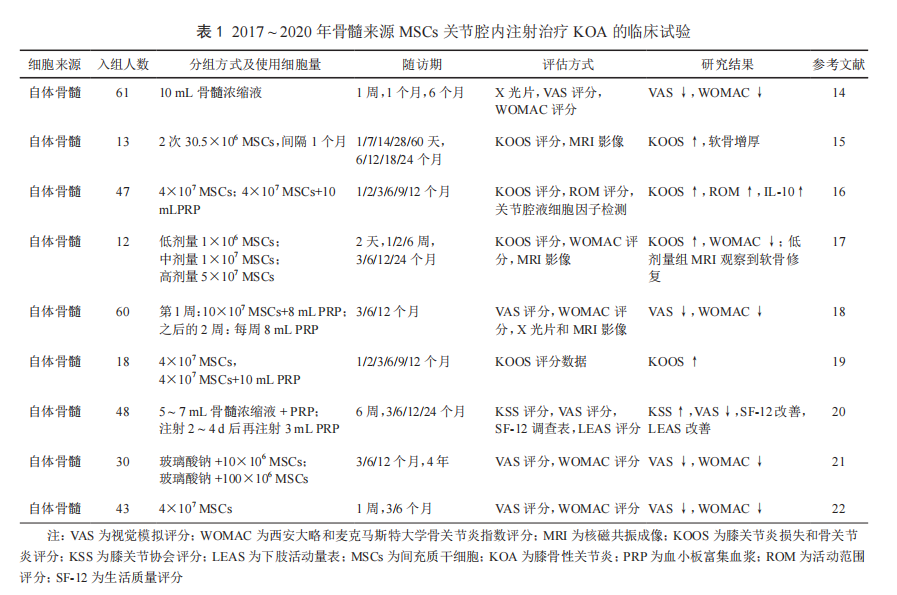
从开展骨髓来源 MSCs 治疗 KOA 以来 [13],国内外许多医院相继开展了大量临床试验。注射的制剂包括骨髓浓缩液、分离扩增后的 MSCs 或加与不加血小板富集血浆(platelet-rich plasma,PRP)的 MSCs。患者接受治疗后,关节软骨和半月板的损伤有明显修复,膝关节功能评分和膝关节疼痛评分都有显著改善(表 1)[14-22]。研究表明骨髓来源的 MSCs 成软骨分化能力高,原因在于其表达较多的Ⅰ型胶原蛋白,较易分化为透明软骨 [23]。从上述临床试验来看,不同治疗方案中骨髓细胞的注射量也不同,以 40×106 个 MSCs 加或不加 PRP 为多。注射体积一般是5 ~ 10 mL。治疗后关节表现评分升高,而关节炎指数下降。与脂肪和脐带相比,用骨髓来源的 MSCs 治疗 KOA 的文献报道数量最高。但其不足之处是抽取自体骨髓会为患者带来继发感染的风险和骨损伤。另外,直接使用骨髓浓缩液,还会因含有大量造血干细胞以及其他种类细胞或物质,影响后续疗效机制的评价。因此,近年来越来越多的 KOA 治疗倾向于使用脂肪来源的 MSCs。异体骨髓治疗 KOA 的临床研究很少,仅在 2015 和 2016年各查到 1 篇文章。2015 年的报道是来自西班牙学者的研究,他们用来自 3 名健康供者的骨髓,混合后经 22 天左右扩增建立 MSCs 库。实验组膝关节内注射 40×106 个异体骨髓 MSCs,对照组注射透明质酸(60 mg/3 mL)。30 例 KOA患者经随访一年,结果表明实验组在量表功能指标方面有显著改善,影像学检测表明实验组软骨密度增加 [24]。但另一篇2016 年的文章结果有所不同,印度学者同样也是用 3 名健康供者骨髓制备 MSCs,在 60 例 KOA 患者治疗中,观察不同剂量(25/50/75/150×106 个细胞量)异体骨髓 MSCs 的作用,从主观量表评分方面看,只有低剂量组有改善;在影像学方面,实验组与基线和对照组分别相比也没有明显差异。副作用多见于高剂量组,表现为关节疼痛和肿胀 [25]。上述结果提示异体骨髓 MSCs 对 KOA 的治疗存在不确定性,加上异体骨髓存在宿主排斥反应的可能,需要慎重使用。
(二)脂肪来源的 MSCs
用脂肪来源的 MSCs 治疗 KOA 开始于 2014 年 [26]。前期需要进行简单的抽脂手术,经消化处理制成单个细胞,用无血清培养基在培养瓶中扩增 MSCs。从研究方案看,细胞用量从 1×107 到 10×107 不等,治疗后经西安大略和麦克马斯特大学骨关节炎指数评分(WOMAC),视觉模拟评分(VAS)和生活质量调查表(SF-36)等评价表明关节功能呈现不同程度的改善,软骨组织体积增加,疼痛减轻及 MRI 影
像学显示软骨损伤改善。从 clinicaltrial.gov 网站上注册的 MSCs 治疗 KOA 的
临床试验数量可以看出(图 2),越来越多的 KOA 治疗选择自体脂肪来源的 MSCs。脂肪源 MSCs 取材简便,经扩增可得到大量比较均一的细胞,并且具有比较好的成软骨分化
能力。异体脂肪 MSCs,无论是低剂量还是高剂量,也能改善KOA 引起的症状。异体脂肪用量最高可达 1×108 (两次注射总量)(表 2)[34] 。表 2 介绍了 3 项异体脂肪来源的 MSCs治疗 KOA 的临床试验结果,其中 2 项临床试验的细胞用量是一样的,但注射次数不同,1项是单次注射,另 1 项是 2 次注射间隔 3 周。按单次用量来说,最高可达 5×107 个 MSCs。研究分析表明,关节腔内无论注射自体或异体 MSCs,对膝关节症状均有所改善,且无致瘤、感染等不良事件发生 [29-31]。
(三)脐带来源的 MSCs
新生儿脐带也是 MSCs 的一个重要来源。从脐带组织或脐带血中获得的 MSCs 可用于不同个体的关节腔内注射,同样达到治疗 KOA 的效果 [35]。2012 年,韩国 FDA 批准了一款产品 Cartistem (脐带来源 MSCs 和玻璃酸钠 ) 上市,治疗KOA 和软骨损伤。不过在 2017 ~ 2020 年期间,仅查到 2 个临床试验报道:1 是用 0.5×107 /mL 细胞量治疗 6 个月时各评分达到最优改善,在 3 年时可见软骨修复,7 年内稳定并未见不良反应 [35]。另外 1 项比较了注射 1 次和注射 2 次的效果,发现注射 2 次的治疗效果更显著,经 WOMAC 评分疼痛感觉改善明显 [36]。脐带源 MSCs 属于异体细胞,虽然注射到体内后有可能会比自体细胞更快地被清除掉,但临床试验表明其疗效可稳定持续 3 ~ 7 年(表 3)[35-36],提示 MSCs 的潜在作用
可能是长期的。在软骨形成实验中,比较不同来源 MSCs 作用,发现脐带来源的 MSCs 可产生较多的Ⅰ型、Ⅱ型胶原蛋白,而骨髓来源的 MSCs 可以形成比较均质、高质量的细胞外基质。相对于骨髓来源的 MSCs,脂肪来源的 MSCs 软骨分化能力较低,基质蛋白分泌量较少,Ⅰ型胶原蛋白基因表达量也相对较
低 [23]。因此,骨髓、脂肪或脐带来源的 MSCs 各有优势,治疗软骨损伤可根据技术条件和患者情况来选择。
三、国内 MSCs 治疗 KOA 的研究进展
经查阅国家药监局网站,目前国内开展 MSCs 治疗 KOA临床项目的有西比曼公司和上海爱萨尔生物科技有限公司。从 2013 年起,西比曼公司开展了自体脂肪来源的 MSCs 产品 Re-Join 和异体脂肪来源的 MSCs 产品 AlloJoin 治疗膝关节炎的研究,国内已进入Ⅱ期临床试验。用 WOMAC、VAS 和 SF-36 量表在 6 个月和 12 个月时评价,Re-Join 组的症状比治疗前改善,并且透明软骨体积增多比透明质酸组更明显 [31]。异体脂肪来源的 MSCs 也能改善 WOMAC 和SF- 36 的评分 [34]。另一家上海爱萨尔公司用人脐带 MSCs 注射液治疗 KOA 的Ⅰ期临床结果尚未公布。
从中国临床试验注册中心网站上查询到国内 MSCs 的治疗项目总共 182 项,而 MSCs 治疗 KOA 的相关项目只有12 项,这些项目包括非注册性的临床研究。2017 年《实用骨科杂志》上报道了膝关节腔内注射脂肪来源的 MSCs(2×107 个)治疗膝关节炎,30 例 KOA 患者在治疗后第 2 ~3 个月,VAS 评分、关节活动的评分都较治疗前有明显改善,MRI 观察软骨面 T2 值较治疗前明显降低,说明 MSCs 对膝关节软骨退变有一定的治疗效果 [37]。其他相关的临床试验,例如,脐带 MSCs 治疗轻、中、严重膝骨关节炎 [38-39],自体骨髓MSCs 复合 PRP 治疗早期膝骨关节炎 [40],与对照相比,MSCs使用组均能明显地缓解疼痛,改善关节功能。
四、存在问题及展望
开展 MSCs 的临床应用目前仍然面临着两大关键的实际问题,一是 MSCs 的来源,二是治疗 KOA 的 MSCs 剂量、途径和评判标准。从不同来源来说,无论是脂肪、骨髓,还是脐带来源的MSCs 在 KOA 临床治疗中都产生了一定疗效,但就取材来说,优势是脐带 > 脂肪 > 骨髓。有关这 3 种来源的 MSCs 在
基因表达、增殖能力和分化潜能等方面的差异,已有多篇研究在体内或体外实验中进行了阐述 [41-43]。另外,还需要考虑采集样本的合规性,批量细胞制剂生产的规模化,保存后活性,冻存方法和冷链运输等问题。 一些细胞示踪性实验表明,MSCs 注射到关节腔内后,大部分细胞在数天内死亡,仅有约 3 ﹪的细胞附着在软骨表面存活。这表明 MSCs 治疗 KOA 的关键并不仅仅是存活下来的部分细胞本身的分化修复能力,还在于 MSCs 旁分泌带来的其他影响:(1)MSCs 凋亡前分泌的大量外泌蛋白质;
(2)外源 MSCs 大量凋亡激活自体 MSCs 活化及免疫调节;
(3)MSCs 分泌的外泌体起到的辅助治疗作用 [44]。MSCs 细胞用量尚缺乏统一的标准。不同研究团队即使用同一细胞来源,针对同一适应症的临床试验,细胞用量可以从 106 到 108 数量不等,并且经常与其他生物成分混用,例如血小板裂解物、PRP 和玻璃酸钠等。因此,大样本量和不同病期、年龄、性别及发病原因的深入分析,才能有助于建立个性化的、精准有效的和规范的治疗方法。MSCs 治疗 KOA 以及其他关节类疾病的应用研究,不仅包括单一的关节腔内注射细胞的方式,还包括 MSCs 联用支架、MSCs 体外分化为软骨球、半月板 / 交叉韧带手术联用MSCs 帮助术后恢复等,MSCs 的多样化应用将进一步提高
关节疾病的疗效 [2]。
临床给药途径的安全性问题。研究表明无论是通过静脉还是关节腔内注射 MSCs,基本上是安全的。治疗后短期可见不同程度的症状改善,但长期疗效(> 5 年)还有待大量样本的进一步观察。评价MSCs治疗KOA的疗效除了现有的影像学检查外,其他评分方法都具有一定的主观性,需要建立主观与客观相结合的综合评价体系。有报道提出采用体内示踪检测技术来观察 MSCs 治疗效果。例如,Ferumoxytol 是一种纳米氧化铁粒子,2018年被用于MSCs小鼠体内示踪[45],目前正在斯坦福大学用于人体内 MSCs 示踪观察。示踪技术有可能帮助了解 MSCs 细胞注射后究竟何去何从,如何发挥作用,组织损伤如何修复等,这些问题的解决将为 MSCs 的临床治疗和机制研究开辟更广阔的前景。值得一提的是诱导多功能干细胞的临床应用。这种通过重组因子诱导体细胞转化成干细胞,可用来替代骨髓、脂肪和脐带血的制备过程。细胞类型可分为自身诱导多功能干细胞,人类白细胞抗原(human leukocyte antigen,HLA)改变的通用型诱导多功能干细胞,HLA 匹配的异体诱导多功能干细胞和 HLA 不匹配的异体诱导多功能干细胞。2014 年最早在日本开始应用,目前已在Ⅰ型糖尿病、帕金森氏病、黄斑变性、心血管疾病和脊柱损伤等开展治疗,未来希望看到在KOA 的临床应用 [46]。
参考文献:
1 Redler LH, Caldwell JM, Schulz BM, et al. Management of articular cartilage defects of the knee[J]. Phys Sportsmed, 2012, 40(1):20-35.
2 Makris EA, Gomoll AH, Malizos KN, et al. Repair and tissue engineering techniques for articular cartilage[J]. Nat Rev Rheumatol,
2015, 11(1):21-34.
3 Lubis AM, Lubis VK. Adult bone marrow stem cells in cartilage therapy[J]. Acta Med Indones, 2012, 44(1):62-68.
4 Friedenstein AJ, Piatetzky-Shapiro II, Petrakova KV. Osteogenesis in transplants of bone marrow cells[J]. J Embryol Exp Morphol, 1966, 16(3):381-390.
5 Caplan AI. Mesenchymal stem cells[J]. J Orthop Res, 1991, 9(5):641- 650.
6 Chen FH, Tuan RS. Mesenchymal stem cells in arthritic diseases[J]. Arthritis Res Ther, 2008,10(5):223.
7 Maumus M, Jorgensen C, Noel D. Mesenchymal stem cells in regenerative medicine applied to rheumatic diseases: role of secretome and exosomes[J]. Biochimie, 2013, 95(12):2229-2234.
8 Glenn JD, Whartenby KA. Mesenchymal stem cells: Emerging mechanisms of immunomodulation and therapy[J]. World J Stem Cells,
2014, 6(5):526-539.
9 Lazarus HM, Haynesworth SE, Gerson SL, et al. Ex vivo expansion and subsequent infusion of human bone marrow-derived stromal progenitor cells (mesenchymal progenitor cells): implications for therapeutic use[J]. Bone Marrow Transplant, 1995, 16(4):557-564.
10 杨振, 李浩, 付力伟, 等. 膝关节内干细胞/祖细胞在软骨再生中作用研究进展[J]. 中华细胞与干细胞杂志(电子版), 2021, 11(1):51-56.
11 Wakitani S, Goto T, Pineda SJ, et al. Mesenchymal cell-based repair of large, full-thickness defects of articular cartilage[J]. J Bone Joint Surg Am, 1994, 76(4):579-592.
12 Murphy JM, Fink DJ, Hunziker EB, et al. Stem cell therapy in a caprine model of osteoarthritis[J]. Arthritis Rheum, 2003, 48(12):3464-3474.
13 Centeno CJ, Busse D, Kisiday J, et al. Increased knee cartilage volume in degenerative joint disease using percutaneously implanted, autologous mesenchymal stem cells[J]. Pain physician, 2008, 11(3):343-353.
14 Garay-Mendoza D, Villarreal-Martinez L, Garza-Bedolla A, et al. The effect of intra-articular injection of autologous bone marrow stem cells on pain and knee function in patients with osteoarthritis[J]. Int J Rheum Dis, 2018, 21(1):140-147.
15 Al-Najar M, Khalil H, Al-Ajlouni J, et al. Intra-articular injection of expanded autologous bone marrow mesenchymal cells in moderate and severe knee osteoarthritis is safe: a phase I/II study[J]. J Orthop Surg Res, 2017,12(1):190.
16 Bastos R, Mathias M, Andrade R, et al. Intra-articular injection of culture-expanded mesenchymal stem cells with or without addition of platelet-rich plasma is effective in decreasing pain and symptoms in knee osteoarthritis: a controlled, double-blind clinical trial[J].Knee Surg Sports Traumatol Arthrosc, 2020, 28(6):1989-1999.
17 Chahal J, Gomez-Aristizabal A, Shestopaloff K, et al. Bone marrow mesenchymal stromal cell treatment in patients with osteoarthritis
results in overall improvement in pain and symptoms and reduces synovial inflammation[J]. Stem Cells Transl Med, 2019, 8(8):746-757.
18 Lamo-Espinosa JM, Blanco JF, Sanchez M, et al. Phase II multicenter randomized controlled clinical trial on the efficacy of intra-articular injection of autologous bone marrow mesenchymal stem cells with platelet rich plasma for the treatment of knee osteoarthritis[J]. J Transl Med, 2020,18(1):356.
19 Bastos R, Mathias M, Andrade R, et al. Intra-articular injections of expanded mesenchymal stem cells with and without addition of plateletrich plasma are safe and effective for knee osteoarthritis[J]. Knee Surg Sports Traumatol Arthrosc, 2018, 26(11):3342-3350.
20 Centeno C, Sheinkop M, Dodson E, et al. A specific protocol of autologous bone marrow concentrate and platelet products versus exercise therapy for symptomatic knee osteoarthritis: a randomized controlled trial with 2 year follow-up[J]. J Transl Med,2018,16(1):355.
21 Lamo-Espinosa JM, Mora G, Blanco JF, et al. Intra-articular injection of two different doses of autologous bone marrow mesenchymal stem cells versus hyaluronic acid in the treatment of knee osteoarthritis: long-term follow up of a multicenter randomized controlled clinical trial (phase I/ II)[J]. J Transl Med, 2018, 16(1):213.
22 Emadedin M, Labibzadeh N, Liastani MG, et al. Intra-articular implantation of autologous bone marrow-derived mesenchymal stromal cells to treat knee osteoarthritis: a randomized, triple-blind, placebocontrolled phase 1/2 clinical trial[J]. Cytotherapy, 2018,20(10):1238-
1246.
23 Jayaram P, Ikpeama U, Rothenberg JB, et al. Bone marrow-derived and adipose-derived mesenchymal stem cell therapy in primary knee osteoarthritis: a narrative review[J]. PM R, 2019, 11(2):177-191.
24 Vega A, Martin-Ferrero MA, Del Canto F, et al. Treatment of knee osteoarthritis with allogeneic bone marrow mesenchymal stem cells: a randomized controlled trial[J]. Transplantation, 2015, 99(8):1681-1690.
25 Gupta PK, Chullikana A, Rengasamy M, et al. Efficacy and safety of adult human bone marrow-derived, cultured, pooled, allogeneic
mesenchymal stromal cells (Stempeucel(R): preclinical and clinical trial in osteoarthritis of the knee joint[J]. Arthritis Res Ther, 2016, 18(1):301.
26 Jo CH, Lee YG, Shin WH, et al. Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: a proof-ofconcept clinical trial[J]. Stem cells, 2014, 32(5):1254-1266.
27 Song Y, Du H, Dai C, et al. Human adipose-derived mesenchymal stem cells for osteoarthritis: a pilot study with long-term follow-up and repeated injections[J]. Regen Med, 2018, 13(3):295-307.
28 Jo CH, Chai JW, Jeong EC, et al. Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: A 2-year follow-up study[J]. Am J Sports Med, 2017, 45(12):2774-2783.
29 Freitag J, Bates D, Wickham J, et al. Adipose-derived mesenchymal stem cell therapy in the treatment of knee osteoarthritis: a randomized controlled trial[J]. Regen Med, 2019, 14(3):213-230.
30 Lee WS, Kim HJ, Kim KI, et al. Intra-articular injection of autologous adipose tissue-derived mesenchymal stem cells for the treatment of knee osteoarthritis: a phase IIb, randomized, placebo-controlled clinical trial[J]. Stem Cells Transl Med, 2019, 8(6):504-511.
31 Lu L, Dai C, Zhang Z, et al. Treatment of knee osteoarthritis with intra-articular injection of autologous adipose-derived mesenchymal
progenitor cells: a prospective, randomized, double-blind, activecontrolled, phase IIb clinical trial[J]. Stem Cell Res Ther, 2019, 10(1):143.
32 Zhao X, Ruan J, Tang H, et al. Multi-compositional MRI evaluation of repair cartilage in knee osteoarthritis with treatment of allogeneic human adipose-derived mesenchymal progenitor cells[J]. Stem Cell Res Ther, 2019, 10(1):308.
33 Kuah D, Sivell S, Longworth T, et al. Safety, tolerability and efficacy of intra-articular Progenza in knee osteoarthritis: a randomized doubleblind placebo-controlled single ascending dose study[J]. J Transl Med, 2018, 16(1):49.
34 Lu L, Dai C, Du H, et al. Intra-articular injections of allogeneic human adipose-derived mesenchymal progenitor cells in patients with
symptomatic bilateral knee osteoarthritis: a Phase I pilot study[J]. Regen Med, 2020, 15(5):1625-1636.
35 Park YB, Ha CW, Lee CH, et al. Cartilage regeneration in osteoarthritic patients by a composite of allogeneic umbilical cord blood-derived mesenchymal stem cells and hyaluronate hydrogel: results from a clinical trial for safety and proof-of-concept with 7 years of extended follow-up[J]. Stem Cells Transl Med, 2017, 6(2):613-621.
36 Matas J, Orrego M, Amenabar D, et al. Umbilical cord-derived mesenchymal stromal Cells (MSCs) for knee osteoarthritis: repeated
MSC dosing is superior to a single MSC dose and to hyaluronic acid in a controlled randomized phase I/II trial[J]. Stem Cells Transl Med, 2019, 8(3):215-224.
37 韩建, 殷振华, 张亚军,等. 人自体脂肪间充质干细胞治疗骨关节炎的临床研究[J]. 实用骨科杂志, 2017, 23(3):235-239.
38 哈承志, 李伟, 任少达, 等. 富血小板血浆联合间充质干细胞治疗膝骨关节炎的疗效[J]. 中华关节外科杂志(电子版), 2018, 12(5):644-652.
39 杨孝兵, 蒋峰, 张帆, 等. 脐带间充质干细胞治疗严重膝骨关节炎的对照研究[J]. 中国临床药理学与治疗学, 2017, 22(3):305-311.
40 程文丹, 徐生林, 吴小三,等. 自体骨髓间充质干细胞复合富血小板血浆治疗早期膝关节骨关节炎疗效观察[J]. 中华全科医学, 2019, 17(10):1652-1655.
41 Mahmoudian-Sani MR, Mehri-Ghahfarrokhi A, Hashemzadeh-Chaleshtori M, et al. Comparison of three types of mesenchymal stem
cells (bone marrow, adipose tissue, and umbilical cord-derived) as potential sources for inner ear regeneration[J]. Int Tinnitus J, 2017, 21(2):122-127.
42 Heo JS, Choi Y, Kim HS, et al. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue[J]. Int J Mol Med, 2016, 37(1):115-125.
43 Stanko P, Kaiserova K, Altanerova V, et al. Comparison of human mesenchymal stem cells derived from dental pulp, bone marrow, adipose tissue, and umbilical cord tissue by gene expression[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2014, 158(3):373-
377.
44 Barry F. MSC therapy for osteoarthritis: an unfinished story[J]. J Orthop Res, 2019, 37(6):1229-1235.
45 Liu L, Ho C. Mesenchymal stem cell preparation and transfection-free ferumoxytol labeling for MRI cell tracking[J]. Curr Protoc Stem Cell Biol, 2017, 43:2B.7.1-2B.7.14. doi: 10.1002/cpsc.38.
46 Okano H, Sipp D. New trends in cellular therapy[J]. Development, 2020, 147(18):dev192567. doi: 10.1242/dev.192567.
(收稿日期 :2021-02-25)
(本文编辑 :陈媛媛)